¿Qué son los radicales libres?
Con mucha frecuencia oímos que los radicales libres son muy
perjudiciales para la salud. Pero, ¿qué son exactamente? ¿Por qué se forman?
Aunque no nos demos cuenta, cada segundo estamos liberando
una batalla interna en nuestros organismos. Se trata de la lucha entre los
antioxidantes y los radicales libres.
Hasta ahí nos puede importar más o menos. Sin embargo, con
mucha frecuencia, oímos que los radicales libres son muy perjudiciales para la
salud. ¿Es esto cierto? ¿Qué es un radical libre? ¿Cómo se forman? A
continuación, vamos a intentar despejar algunas dudas al respecto.
Explicando los radicales libres
Se trata de un átomo o molécula (conjunto de átomos) con dos
o más electrones desacoplados. Hay que recordar que los electrones gravitan
alrededor del núcleo del átomo, al igual que los planetas alrededor del Sol,
solo que acoplados.

Si uno de estos electrones, por cualquier motivo, se sale de
su órbita, la molécula se convierte en un radical libre, altamente inestable y
energética. Para recuperar dicha estabilidad, tiene que “robar” un electrón a
otro átomo vecino (un proceso denominado oxidación), lo que hace que éste se
vuelva reactivo, y así sucesivamente.
¿Por qué se forman?
Los radicales libres son moléculas inestables que recorren
nuestro cuerpo intentando robar un electrón con vistas a recuperar su
estabilidad electroquímica. Esto las hace muy peligrosas, porque para
conseguirlo atacan moléculas estables. Una vez que el radical libre ha
conseguido robar el electrón que necesita para emparejar su electrón libre, la
otra molécula se convierte a su vez en un radical libre, iniciándose así un
ciclo destructivo para nuestras células.
El organismo produce radicales libres con el objetivo de
luchar frente a la acción negativa de virus y bacterias. Es decir, nos
encontramos ante un mecanismo de defensa creado por nuestro propio cuerpo. Sin
embargo, para que su acción no se convierta en nociva para nuestra salud y en
un auténtico “peligro”, es necesario que sean controlados mediante la
protección antioxidante.
¿Cuáles son los principales radicales libres?
Los radicales libres más reactivos son los siguientes:
Ión superóxido – Se forma a partir de oxígeno.
Radical hidróxilo – Se forma a partir de peróxido de
hidrógeno. Está considerado el más peligroso de todos.
Oxígeno singleto – Se produce cuando la luz ultravioleta o
el ozono afectan a las células del organismo.
Todas estas moléculas reactivas deben eliminarse para poder
conservar la vida celular
¿Cómo se pueden combatir?
Los antioxidantes son sustancias que liberan electrones en
nuestra sangre, los cuales son captados por los radicales libres, volviéndose
con ello en moléculas estables.
Precisamente para evitar que los radicales libres roben
electrones a nuestras células, y se conviertan por tanto en un auténtico
peligro para nuestra salud, es importantísimo seguir una dieta rica en
alimentos antioxidantes.
radicales libres antioxidantes
Para ello, basta con seguir una alimentación sana y
equilibrada, rica en alimentos naturales y frescos, como por ejemplo es el caso
de frutas y verduras, cereales integrales, frutos secos, pescado, carnes
blancas y té verde.
Tipos de antioxidantes
Los antioxidantes pueden ser de origen endógenos y exógenos:
Antioxidantes endógenos: están en las células, para evitar
que haya una superproducción o un acumuló de radicales libres. Si hay una
disminución de los antioxidantes endógenos porque se gasten neutralizando el
exceso de radicales libres, nosotros podemos aumentar los antioxidantes a
través de la dieta.
Antioxidantes exógenos: son las vitaminas C y E; los
carotenoides: pigmentos sintetizados por la planta como el betacaroteno y el
licopeno; o los flavonoides. Todos estos antioxidantes se encuentran fundamentalmente
en las frutas, las verduras, las hortalizas, las legumbres y las semillas.
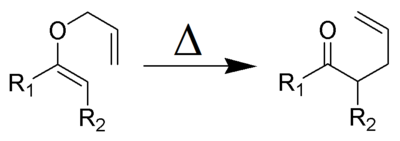
Ejemplo de mecanismos de
reacciones orgánicas polares y no polares
Adición de ácido bromhídrico a un doble enlace en presencia
de peróxido, vea usted el capítulo cuarto de los alquenos más adelante
Un ejemplo de b) es el que sigue: Es una reacción de
sustitución de un hidrógeno en un alcano por un átomo “A”, que puede ser un
halógeno como cloro o bromo. (vea el capítulo tres “sobre las reacciones de los
alcanos”) Las dos reacciones que se muestran se conocen como etapa de
propagación y son las más importantes en este tipo.
Todas las reacciones por radicales libres poseen tres fases:
Una de Inicio, otra de Propagación y la última de Término.
Un esquema típico de una reacción de sustitución, es la
bromación del metano por el método de los radicales libres es:
La fase más importante en este caso, como ya se mencionó, es
la propagación, y la razón de ello es debido a que por cada molécula de
iniciador, (Br2) que se rompe, paso (A), se genera solo dos radicales libres,
en cambio en la etapa de propagación, pasos (B y C) en donde se produce la
sustitución, se repite unas 105 veces.
Por último, la fase de terminación, es aquella en la que dos
o más de los radicales activos de la reacción se encuentran generando una
partícula o molécula no activa. Esto ocurre lentamente hasta que la reacción se
detiene si no hay mayor estímulo.