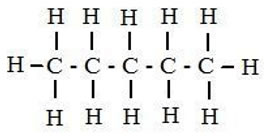hidrocarburos
que son?
Los hidrocarburos son compuestos orgánicos formados únicamente por átomos de carbono e hidrógeno. Son los compuestos básicos que estudia la química orgánica.
Los hidrocarburos se clasifican en 2 que son alifáticos y romáticosa. Los alifáticos, según el tipo de enlace se dividen en :
Los átomos de carbono están unidos por enlaces sencillos. Su fórmula molecular es CnH2n+2 donde n es el número de átomos de carbono de la cadena.
Al menos hay dos átomos de carbono que están unidos por un doble enlace. Responden a la fórmula molecular CnH2n
Alquinos.
Alquinos.
Almenos hay dos átomos de carbono que están unidos por un enlace triple. Responden a la fórmula molecular CnH2n-2
PROPIEDADES DE LOS HIDROCARBUROS
Las principales propiedades de los hidrocarburos saturados son las siguientes:
A temperatura ambiente, los cuatro primeros son gases. Del C5H12 al C15H32 son líquidos, y los siguientes son sólidos.
Las temperaturas de ebullición son bajas y aumentan con la longitud de la cadena carbonada.
La densidad es menor que la del agua, y también aumenta a medida que lo hace la longitud de la cadena carbonada. Varía desde 0´55 g/cm3 para el más pesado.
Son insolubles en el agua y solubles en disolventes orgánicos.
Tienen escasa reactividad, ya que son muy estables